La dĂŠcharge d'une batterie acide-plomb
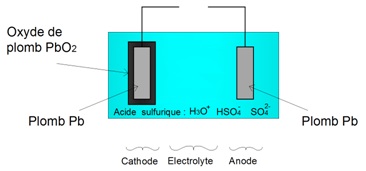 Un accumulateur ĂŠlectrochimique au plomb est constituĂŠ de trois ĂŠlĂŠments majeurs :
Un accumulateur ĂŠlectrochimique au plomb est constituĂŠ de trois ĂŠlĂŠments majeurs :1) Un ĂŠlectrolyte composĂŠ d'acide sulfurique aqueux.
2) Une première Êlectrode constituÊe de plomb. Cette Êlectrode s'appelle l'anode.
3) Une deuxième Êlectrode constituÊe d'oxyde de plomb. Cette Êlectrode s'appelle la cathode.

Electrode d'une batterie acide-plomb

Photographie d'une batterie acide-plomb constituĂŠe de plusieurs ĂŠlectrodes baignant dans l'ĂŠlectrolyte
Principe ĂŠlectrochimique de la dĂŠcharge d'une batterie acide-plomb
La dĂŠcharge d'une batterie repose sur la thĂŠorie des rĂŠactions d'oxydorĂŠduction.RĂŠaction d'oxydorĂŠduction
Une rĂŠaction d'oxydorĂŠduction est une rĂŠaction chimique au cours de laquelle se produit un transfert d'ĂŠlectron. Elle fait intervenir 2 couples d'ĂŠlĂŠments chimiques, appelĂŠs communĂŠment couples oxydo-rĂŠducteurs.
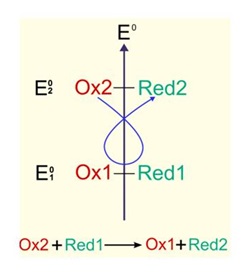
Principe des rĂŠactions d'oxydorĂŠduction
La rĂŠaction dâoxydorĂŠduction se dĂŠcompose en deux rĂŠactions :
=> Une rĂŠaction dâoxydation; le rĂŠducteur sâoxyde selon lâĂŠquation suivante : Red1 → Ox1 + ĂŠlectrons
=> Une rĂŠaction de rĂŠduction; lâoxydant se rĂŠduit selon lâĂŠquation suivante : Ox2 + ĂŠlectrons → Red2
La rĂŠaction dâoxydorĂŠduction est alors le bilan de ces deux ĂŠquations : Ox2 + Red1 → Ox1 + Red2
Chaque couple oxydant-rĂŠducteur est caractĂŠrisĂŠ par un potentiel ĂŠlectrique, mesurĂŠ expĂŠrimentalement dans des conditions dites standard. Les couples ayant un potentiel ĂŠlectrique ĂŠlevĂŠ impliquent des oxydants forts. Les couples ayant un potentiel ĂŠlectrique très bas impliquent des rĂŠducteurs forts. La rĂŠaction dâoxydorĂŠduction se produit toujours entre un oxydant fort et un rĂŠducteur faible. Les rĂŠactions dâoxydorĂŠduction sont des rĂŠactions totales, plus ou moins rapides.
Dans une rĂŠaction dâoxydorĂŠduction, il y a ni crĂŠation ni perte dâĂŠlectron, mais plutĂ´t transfert dâĂŠlectrons qui permettent dâenclencher les deux demi-rĂŠactions.
Dans une batterie acide-plomb, les couples oxydants-rĂŠducteurs mis en jeu sont les couples PbO2/Pb2+ et Pb2+/Pb, dont les potentiels sont indiquĂŠs ci-dessous (par rapport Ă la rĂŠfĂŠrence H+/H2) :
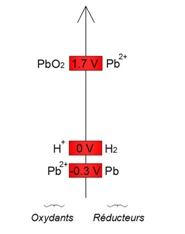 Ainsi, lâoxydant le plus fort est lâoxyde de plomb (PbO2). Celui-ci va se rĂŠduire en lâion Pb2+ selon la demi-ĂŠquation de rĂŠduction suivante : PbO2 + 4 H3++ + 2 e- → Pb2+ + 6 H2O (1)
Ainsi, lâoxydant le plus fort est lâoxyde de plomb (PbO2). Celui-ci va se rĂŠduire en lâion Pb2+ selon la demi-ĂŠquation de rĂŠduction suivante : PbO2 + 4 H3++ + 2 e- → Pb2+ + 6 H2O (1)De mĂŞme, le rĂŠducteur le plus fort est le plomb (Pb). Celui-ci va sâoxyder en lâion Pb2+ selon la demi-ĂŠquation dâoxydation suivante : Pb → Pb2+ + 2 e- (2)
On obtient la rĂŠaction dâoxydorĂŠduction suivante : PbO2 + 4 H3++ + Pb + 2 e- → Pb2+ + 6 H2O + Pb2+ + 2 e-
Certains ĂŠlĂŠments sâannulent de part et dâautres de lâĂŠquation, et on obtient finalement : PbO2 + 4 H3++ + Pb → 2 Pb2+ + 6 H2O
Nous constatons que la rĂŠaction dâoxydation (2) libère un ĂŠlectron. Cet ĂŠlectron peut ĂŞtre utilisĂŠ par lâoxyde de plomb (PbO2) afin dâenclencher la rĂŠaction de rĂŠduction (1). Pour cela, on rĂŠalise une connexion ĂŠlectrique entre lâanode et la cathode permettant la circulation des ĂŠlectrons. Ce processus est illustrĂŠ sur le schĂŠma ci-dessous :
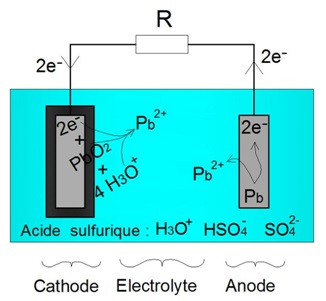
Principe ĂŠlectrochimique de la dĂŠcharge d'une batterie acide-plomb
Lâanode en plomb perd donc petit Ă petit sa masse. Egalement la masse dâoxyde de plomb (PbO2) diminue :
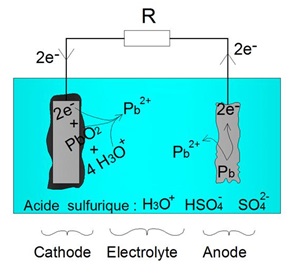
Principe ĂŠlectrochimique de la dĂŠcharge d'une batterie acide-plomb
Pourquoi la cathode est-elle constituĂŠe ĂŠgalement de plomb ?
Les ĂŠlectrodes des batteries (qui se prĂŠsentent sous la forme de grille), doivent prĂŠsenter une bonne tenue Ă la corrosion en milieu acide sulfurique et une bonne conductivitĂŠ ĂŠlectrique. Le plomb est l'un des seuls matĂŠriaux Ă disposer de ces propriĂŠtĂŠs (en plus de la tenue mĂŠcanique). En effet, lâoxyde de plomb prĂŠsente une conductivitĂŠ ĂŠlectrique de Ω-1.cm-1. Quant au plomb, sa conductivitĂŠ est presque 200 fois supĂŠrieure : 48 000 Ω-1.cm-1.
De ce fait, la cathode est en plomb avec une couche superficielle en oxyde de plomb. C'est bien l'oxyde de plomb qui participe aux rĂŠactions chimiques.
Les fabricants ainsi que les organisme de recherche travaillent plutĂ´t sur des cathodes en alliages de plomb (plomb-antimoine, plomb-ĂŠtain, plomb-calcium-ĂŠtain, etc).
DÊcharge profonde & PhÊnomène de sulfatation d'une batterie acide-plomb
Les batteries acide-plomb sont vulnĂŠrables aux dĂŠcharges profondes.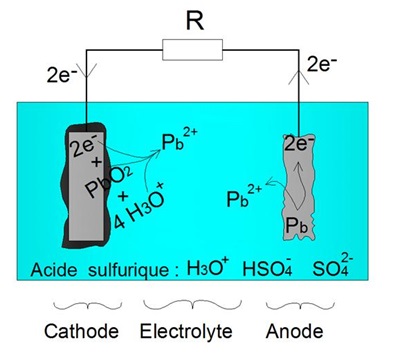 Ainsi qu'expliquĂŠ prĂŠcĂŠdemment, la dĂŠcharge d'une batterie acide-plomb produit des ions Pb2++ (voir schĂŠma ci-contre). Ainsi, au cours de la dĂŠcharge, on observe une augmentation de la concentration des ions Pb2+ au sein de l'ĂŠlectrolyte.
Ainsi qu'expliquĂŠ prĂŠcĂŠdemment, la dĂŠcharge d'une batterie acide-plomb produit des ions Pb2++ (voir schĂŠma ci-contre). Ainsi, au cours de la dĂŠcharge, on observe une augmentation de la concentration des ions Pb2+ au sein de l'ĂŠlectrolyte.Or, les ions Pb2+ sont relativement peu solubles dans une solution dâacide sulfurique. En effet, en prĂŠsence de lâĂŠlĂŠment SO42- au sein de l'ĂŠlectrolyte (voir schĂŠma ci-contre), les ions Pb2+ rĂŠagissent pour former du sulfate de plomb PbSO4, selon lâĂŠquation suivante : Pb2+ + SO42- → PbSO4
Il est à noter que cette rÊaction se produit dès lors que l'Êlectrolyte est saturÊe en ions Pb2+, à savoir pour une concentration de l'ordre de 1.1 à 10-4 mol/L. Dans la pratique, cette rÊaction (transformation des ions Pb2+ en sulfate de plomb PbSO4) apparaÎt à partir d'une profondeur de dÊcharge de l'ordre de 50%.
Lorsque lâaccumulateur est complètement chargĂŠ, thĂŠoriquement, la concentration en ion Pb2+ est nulle. Dès quâune dĂŠcharge sâopère, il y a production dâion Pb2+ au niveau des deux ĂŠlectrodes. La concentration en ion Pb2+ augmente jusquâĂ atteindre la valeur limite de saturation (~1.1 Ă 10-4 mol/L). Ensuite, les ions Pb2+ formĂŠs sont directement transformĂŠs en sulfate de plomb (PbSO4).
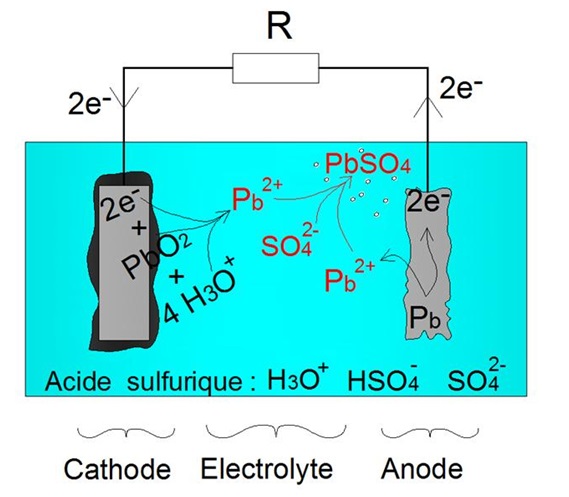
Production de sulfate de plomb PbSO4 lors de la dĂŠcharge d'une batterie
Disparition du sulfate de plomb pendant la recharge de la batterie
Pendant la recharge, la concentration en ion Pb2+ diminue car celui-ci est consommĂŠ par le processus de charge pour former du Plomb (Pb) sur lâanode et de lâoxyde de plomb (PbO2) sur la cathode (voir paragraphe sur la charge d'une batterie acide-plomb). Ainsi, lâĂŠlectrolyte nâest plus saturĂŠe en ions Pb2+, et par suite les cristaux de sulfate de plomb sont dissout selon la rĂŠaction : PbSO4 → Pb2+ + SO42-. Une batterie parfaitement chargĂŠe ne prĂŠsente donc plus de sulfate de plomb.
On dit qu'il y a sulfatation lorsqu'il devient impossible de dissoudre le sulfate de plomb par une charge normale des batteries.
Le phĂŠnomène de sulfatation est problĂŠmatique. En effet, le sulfate de plomb se prĂŠsente sous la forme de cristaux solide qui viennent sâagrĂŠger au niveau des ĂŠlectrodes. Ce phĂŠnomène se dĂŠveloppe au cours des cycles de charge/dĂŠcharge, et s'amplifie d'autant plus que la dĂŠcharge est profonde. A terme, une couche isolante de sulfate de plomb apparaĂŽt et empĂŞche les rĂŠactions chimiques de se produire. Lâaccumulateur voit sa capacitĂŠ fortement diminuer, et Ă terme devient inutilisable.

Par capillaritĂŠ, le sulfate de plomb s'infiltre et remonte jusqu'aux bornes de la batterie
C'est pour cette raison qu'il est proscrit d'effectuer des dĂŠcharges profondes Ă rĂŠpĂŠtition. La limite de dĂŠcharge est donc limitĂŠe Ă environ 70%.
AutodĂŠcharge des batteries acide-plomb
Les batteries au plomb sont soumises Ă de phĂŠnomènes d'autodĂŠcharge. Lâorigine de lâautodĂŠcharge provient des rĂŠactions d'oxydorĂŠductions secondaires se produisant au niveau des ĂŠlectrodes. Contrairement Ă ce qui se passe au cours d'une dĂŠcharge normale, les ĂŠchanges d'ĂŠlectrons ont lieu entre oxydants et rĂŠducteurs d'une mĂŞme ĂŠlectrode, sans transport de charge Ă travers l'ĂŠlectrolyte et donc sans gĂŠnĂŠration de courant.Quelles sont les rĂŠactions secondaires entrainant une autodĂŠcharges des batteries
Ces rĂŠactions secondaires sont nombreuses et plus ou moins prĂŠpondĂŠrantes les unes par rapport aux autres. En outre, ces rĂŠactions secondaires ne sont pas encore toutes identifiĂŠes par la communautĂŠ scientifique.
Nous citerons :
- A la cathode, production d'oxygène. Lâeau de lâĂŠlectrolyte est oxydĂŠe dĂŠgageant du dioxygène gazeux (O2) et 2 ĂŠlectrons. Ces deux ĂŠlectrons sont directement exploitĂŠs par lâoxyde de plomb (PbO2) de la cathode. Le plomb (Pb) est alors rĂŠduit en ions Pb2+.
- A l'anode, production de dihydrogène. Le plomb (Pb) est oxydÊ en ions Pb2+ libÊrant 2 Êlectrons. Ces deux Êlectrons sont directement consommÊs par les ions H3O+ de l'Êlectrolyte. Les ions H3O+ sont alors rÊduits dÊgageant du dihydrogène gazeux (H2).
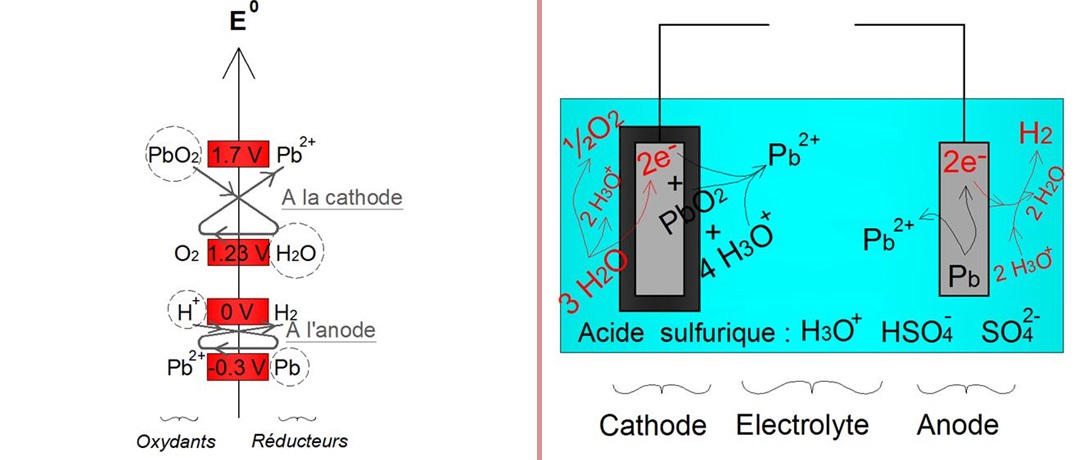
Illustration des rĂŠactions secondaires responsable de l'autodĂŠcharge d'une batterie acide-plomb
Lorsque la batterie est dÊconnectÊe (circuit ouvert), elle s'autodÊcharge. Ainsi, une batterie chargÊe qui ne serait pas sollicitÊe se retrouve complètement dÊchargÊe au bout de plusieurs mois. Le graphe ci-dessous indique les temps d'autodÊcharge typique d'une batterie acide-plomb au repos (en circuit ouvert) en fonction de la tempÊrature ambiante :
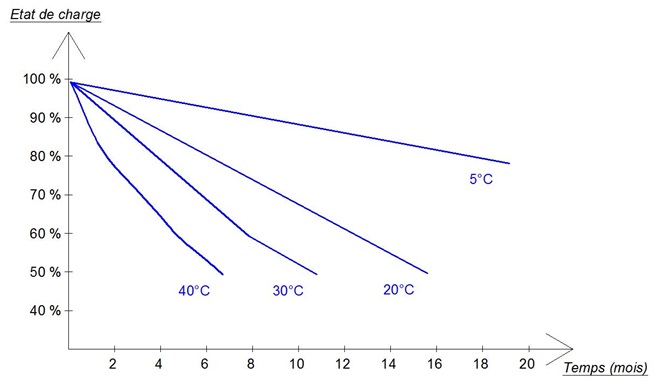
Temps d'autodÊcharge des batteries au plomb en fonction de la tempÊrature ambiante. Les batteries au plomb s'autodÊchargent d'autant plus vite que la tempÊrature ambiante est ÊlevÊe. Le taux d'autodÊcharge des batteries actuelles, en terme de perte de capacitÊ, est rÊduit en moyenne entre 2 % et 5 % par mois (à 20°C).

