La charge d'une batterie acide-plomb
Principe ĂŠlectrochimique de la charge d'une batterie acide-plomb
La charge dâune batterie consiste Ă rĂŠaliser la rĂŠaction chimique inverse de la charge. Cette rĂŠaction inverse nâĂŠtant pas naturellement possible, il convient de rĂŠaliser ce quâon appelle une rĂŠaction forcĂŠe. Pour cela, on utilise un gĂŠnĂŠrateur qui va forcer le passage des ĂŠlectrons dans le sens inverse : on appelle ce procĂŠdĂŠ ĂŠlectrolyse.RĂŠaction d'ĂŠlectrolyse
La rĂŠaction dâĂŠlectrolyse se dĂŠcompose en deux rĂŠactions :
=> Une rĂŠaction de rĂŠduction; l'oxydant le plus faible se rĂŠduit selon l'ĂŠquation suivante : Ox1 + ĂŠlectrons → Red1
=> Une rĂŠaction d'oxydation; le rĂŠducteur le plus faible s'oxyde selon l'ĂŠquation suivante : Red2 → Ox2 + ĂŠlectrons
La rĂŠaction dâĂŠlectrolyse est alors le bilan de ces deux ĂŠquations : Ox1 + Red2 → Ox2 + Red1
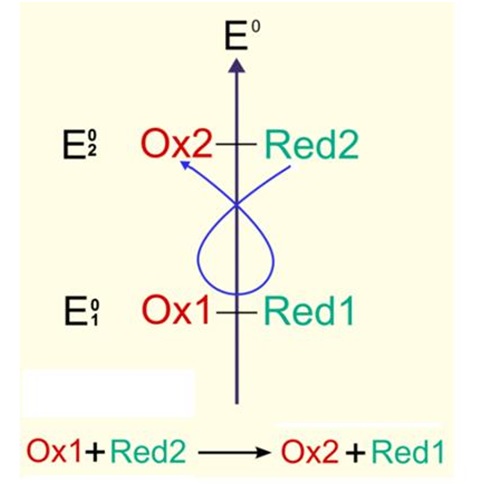
Principe de l'ĂŠlectrolyse lors de la charge d'une batterie
Cette rĂŠaction nâest pas naturelle et il convient de la forcer par la prĂŠsence dâun gĂŠnĂŠrateur ĂŠlectrique.
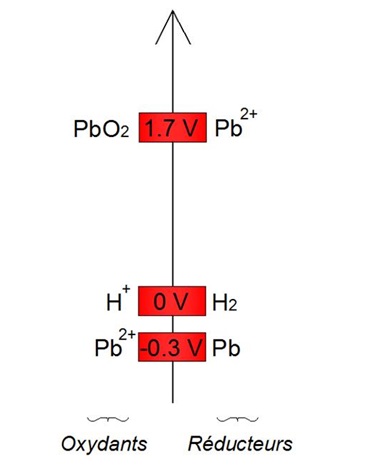
Dans une batterie acide-plomb, les couples oxydants-rĂŠducteurs mis en jeu pour la charge sont les mĂŞme que pour la dĂŠcharge, câest-Ă -dire les couples PbO2/Pb2+ et Pb2+/Pb, dont les potentiels sont indiquĂŠs ci-contre (par rapport Ă la rĂŠfĂŠrence H+/H2).
Ainsi, lâoxydant le plus faible est lâion plomb (Pb2+). Celui-ci va se rĂŠduire en plomb (Pb) selon la demi-ĂŠquation de rĂŠduction suivante : Pb2+ + 2 e- → Pb (1') [RĂŠaction de rĂŠduction forcĂŠe]
De mĂŞme, le rĂŠducteur le plus faible est lâion plomb (Pb2+). Celui-ci va sâoxyder en oxyde de plomb (PbO2) selon la demi-ĂŠquation dâoxydation suivante : Pb2+ + 6 H2O → PbO2 + 4 H3O++ + 2 e- (2') [RĂŠaction dâoxydation forcĂŠe]
On obtient la rĂŠaction dâoxydorĂŠduction forcĂŠe suivante : 2 Pb2+ + 6 H2O → Pb + PbO2 + 4 H3O++ [RĂŠaction dâoxydo-rĂŠduction forcĂŠe]
Le processus est illustrĂŠ ci-dessous :
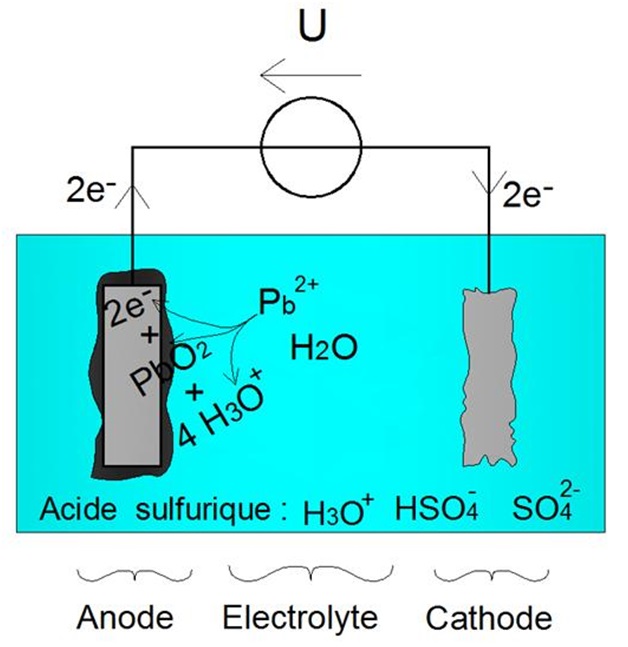
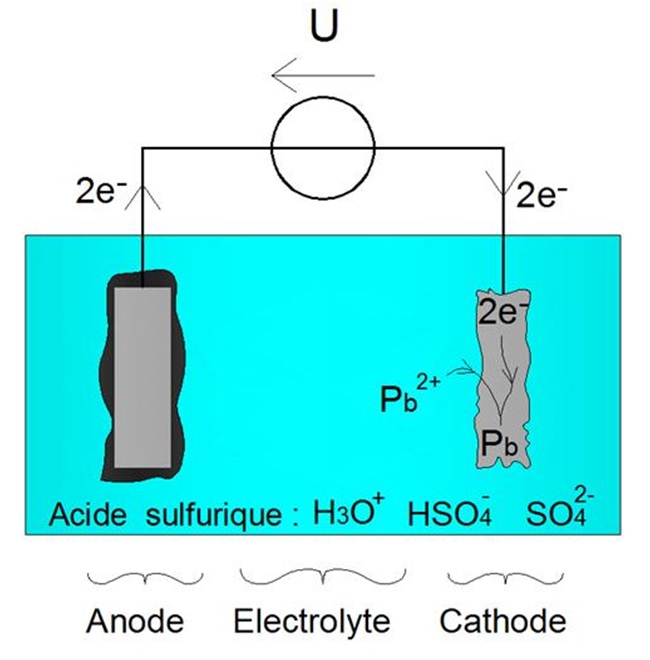
RĂŠaction dâoxydation forcĂŠe Ă lâanode (2') - RĂŠaction de rĂŠduction forcĂŠe Ă la cathode (1')
Les ĂŠlectrodes retrouvent donc leur masse initiale, ainsi quâillustrĂŠ ci-dessous :
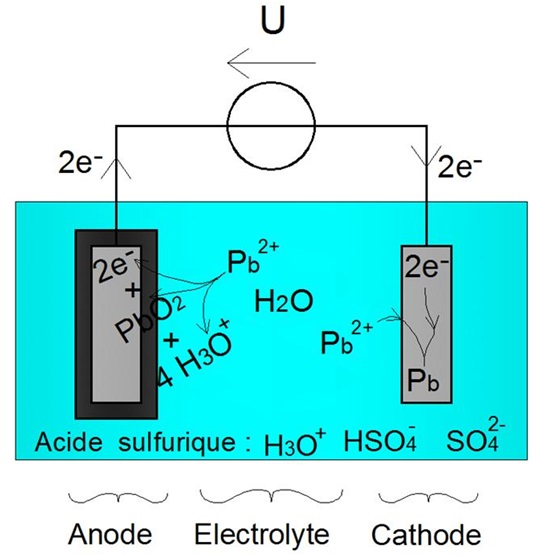
Les ĂŠlectrodes retrouvent leur masse initiale
Stratification de l'ĂŠlectrolyte & Surcharge
L'Êlectrolyte, constituÊ d'acide sulfurique diluÊe dans l'eau, est un paramètre dÊterminant vis-à -vis de la durÊe de vie des Êlectrodes (en par suite de la batterie).Electrolyte optimale
Rappelons que le rĂ´le de l'acide sulfurique principale est de fournir des ions H3O++ entrant dans les rĂŠactions chimiques relatives Ă la dĂŠcharge. Il convient ĂŠgalement que l'ĂŠlectrolyte prĂŠsente une bonne conductivitĂŠ ionique. Ceci permet d'amĂŠliorer l'efficacitĂŠ de la charge en diminuant la rĂŠsistance interne de la batterie.
Or, nous savons que la densitĂŠ de lâĂŠlectrolyte joue un rĂ´le important sur la conductivitĂŠ ionique. Le graphe ci-dessous indique la conductivitĂŠ de lâĂŠlectrolyte en fonction de la densitĂŠ dâacide sulfurique :
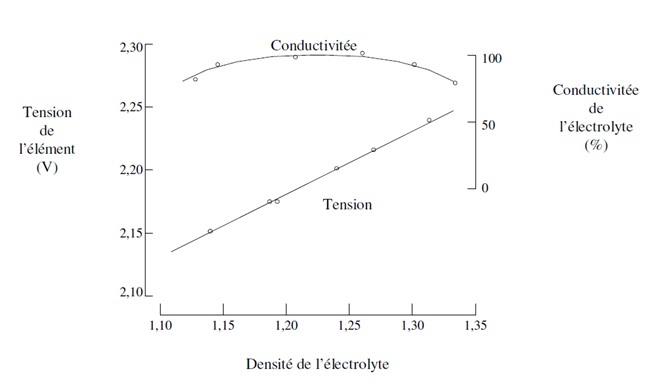
Influence de la densitĂŠ de l'ĂŠlectrolyte sur sa conductivitĂŠ
On remarquera que, pour une densitĂŠ de l'ĂŠlectrolyte comprise entre 1.12 et 1.38, la conductivitĂŠ est maximale. Ces densitĂŠs correspondent Ă une concentration massique d'acide sulfurique de l'ordre 30%.
Typiquement, lorsque la batterie est complètement chargÊe (Êtat de charge de 100%), la densitÊ de l'Êlectrolyte doit être proche de 1.38. Puis, au cours de la dÊcharge, la densitÊ de l'Êlectrolyte diminue jusqu'à une valeur minimale de 1.12 (pour un Êtat de charge de 0%). On veillera donc, lorsque les batteries sont fournies sans Êlectrolyte, à respecter ces valeurs lors du remplissage.
Au fur et à mesure des cycles, la distribution de l'Êlectrolyte devient de moins en moins uniforme. Les ions Êtant plus lourd que l'eau, ils tendent à s'accumuler dans le fond du bas crÊant ainsi une stratification de la densitÊ d'acide. Les consÊquences sont une diminution de la conductivitÊ dans les zones à faible densitÊ d'acide, et une très forte accÊlÊration du phÊnomène de corrosion des grilles pour les zones à densitÊ d'acide supÊrieur à 1.38. En consÊquence, on assiste à une affaiblissement de la capacitÊ de la batterie, et à un vieillissement prÊcoce.
Un moyen pour lutter contre la stratification de lâĂŠlectrolyte est lâapplication dâune lĂŠgère surcharge.
Surcharge des batteries
La surcharge est un ĂŠtat de charge de la batterie pour lequel les ĂŠlĂŠments rĂŠactifs ne sont plus prĂŠsent en quantitĂŠ suffisante (l'ĂŠtat de charge est de 100%).
Lorsque la charge de la batterie est terminĂŠe, la concentration des ions Pb2+ au sein de l'ĂŠlectrolyte devient insuffisante. Ainsi, le gĂŠnĂŠrateur ĂŠlectrique ne contribue plus Ă charger la batterie (de toute façon, celle-ci est complètement chargĂŠe) mais Ă forcer la seule rĂŠaction susceptible de se produire, Ă savoir lâĂŠlectrolyse de lâeau avec un dĂŠgagement gazeux de dihydrogène et de dioxygène important et dangereux.
Electrolyse de l'eau
L'ĂŠlectrolyse de l'eau est une rĂŠaction secondaire qui se produit lors de la charge d'une batterie. Lors du processus de charge, elle n'est pas prĂŠpondĂŠrante par rapport Ă la rĂŠaction primaire (voir le paragraphe sur le principe ĂŠlectrochimique de la charge), cependant elle le devient lorsque la batterie a atteint 100% de son ĂŠtat de charge.
En fin de charge, l'ĂŠlectrolyte est dĂŠpourvu des ions Pb2+. Par consĂŠquent, sous la tension imposĂŠe par le gĂŠnĂŠrateur, la rĂŠaction qui se produit est l'ĂŠlectrolyse de l'eau :
- Oxydation Ă l'anode : 3 H2O + ½ O2 → 2 H3O+ + 2 e-
- RĂŠduction Ă a cathode : 2 H3O+ + 2e- → H2 + 2 H2O
La rÊaction d'Êlectrolyse de l'eau se traduit donc par la production de dioxygène (O2) et de dihydrogène (H2) sous forme gazeuse.
La surcharge est une ĂŠtape importante du processus de charge car elle permet de brasser l'ĂŠlectrolyte. En effet, le dĂŠgagement gazeux issu de l'ĂŠlectrolyse de l'eau permet de remuer l'ĂŠlectrolyte et de l'homogĂŠnĂŠiser, assurant une destratification.
Lors du processus de charge gÊrÊe par le rÊgulateur (Voir le chapitre sur les rÊgulateurs), en fin de charge, la tension de charge aux bornes de la batterie est lÊgèrement surÊlevÊe (de l'ordre de 2.3 V par ÊlÊments) afin d'accÊlÊrer l'Êlectrolyse de l'eau et brasser l'Êlectrolyte.
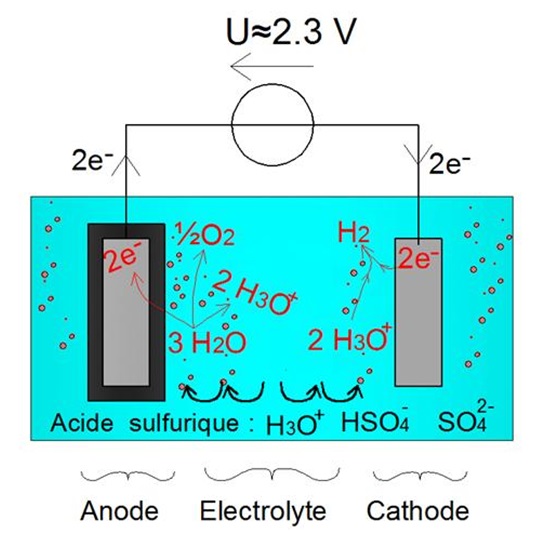
En dĂŠgageant du dihydrogène gazeux et du dioxygène gazeux, la rĂŠaction dâĂŠlectrolyse de lâeau permet de brasser lâĂŠlectrolyte et dâĂŠviter le phĂŠnomène de stratification de lâacide sulfurique. Ce phĂŠnomène est volontairement amplifiĂŠ mais contrĂ´ler par le rĂŠgulateur en fin de charge

Illustration du dĂŠgagement gazeux lors du processus de surcharge permettant une homogĂŠnĂŠisation de l'acide sulfurique au sein de l'ĂŠlectrolyte

L'Êvacuation des gaz (dioxygène et dihydrogène) s'effectue par des orifices situÊs en partie supÊrieure de l'ÊlÊment de la batterie
ConsĂŠquences
Le brassage de l'ĂŠlectrolyte par dĂŠgagement gazeux permet l'homogĂŠnĂŠisation de l'acide sulfurique mais prĂŠsente nĂŠanmoins deux inconvĂŠnients majeurs :
- Le dihydrogène est un gaz explosif au contact de lâoxygène. Dans le cas des batteries ouvertes, il convient que le coffret des batteries soit bien ventilĂŠ par la prĂŠsence notamment dâouvertures. Il est Ă noter que le dihydrogène est dangereux dans lâair lorsque sa teneur est supĂŠrieure Ă 3%.
- La rĂŠaction dâĂŠlectrolyse consomme lâeau de lâĂŠlectrolyte ce qui a pour consĂŠquence de diminuer le niveau de celle-ci mais ĂŠgalement dâaugmenter la concentration de lâacide sulfurique (risque accru de corrosion des ĂŠlectrodes). Il convient en ce sens de rĂŠaliser pĂŠriodiquement des remises Ă niveaux du volume d'eau de l'ĂŠlectrolyte.
Vitesse de charge des batteries acide-plomb
La rapiditÊ de la charge d'une batterie acide-plomb est limitÊe par la lenteur du phÊnomène de diffusion des rÊactifs au sein de l'Êlectrolyte. Egalement, les rÊactions chimiques secondaires (comme l'Êlectrolyse de l'eau) sont un obstacle à la rapiditÊ de la charge.Le processus de charge est gÊrÊ par un rÊgulateur. Les fabricants utilise couramment le procÊdÊ dit "IoUoU". Il s'agit d'un fonctionnement en 3 Êtapes :
- I comme courant : pendant cette 1ère Êtape, on maintient un courant constant. Au fil de la charge, la tension de la batterie augmente. Si on maintient ce courant constant, la tension devient trop ÊlevÊe (ce qui favorise les rÊactions chimiques secondaires), et il convient donc de maintenir une tension constante adaptÊe (Êtape suivante).
- U comme tension : pendant cette 2ème phase, on maintient une tension constante, de l'ordre de 2.2 V (pour un ÊlÊment de batterie de 2 V).
- U comme tension : pendant cette 3ème phase, on maintient une tension constante lÊgèrement supÊrieure à la prÊcÊdente. C'est la surcharge, permettant le brassage de l'Êlectrolyte.
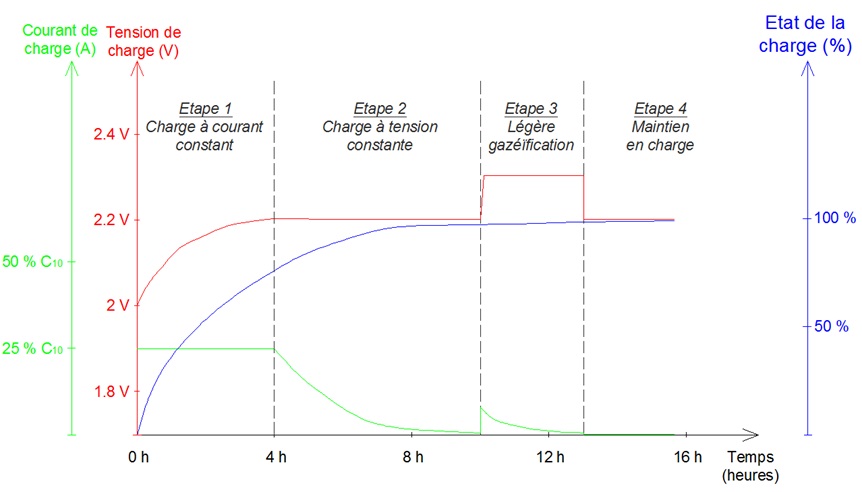
ProcĂŠdĂŠ de charge d'une batterie acide-plomb "IoUoU" couramment utilisĂŠ par les rĂŠgulateurs de charge
Avec ce procÊdÊ, et sous rÊserve que la source d'Ênergie (en l'occurence, dans notre cas, l'Ênergie solaire photovoltaïque) soit suffisante, le temps de charge dure environ 10 h, pour passer d'un Êtat de charge de 0% à 100%. En gÊnÊral, on interdit aux batteries un Êtat de charge infÊrieur à 30% (voir paragraphe "DÊcharge profonde & PhÊnomène de sulfatation"). Par suite, le temps de charge est ramenÊ à plus ou moins 9h.
Dans le cas des installations photovoltaĂŻques autonomes, la durĂŠe de charge du procĂŠdĂŠ IoUoU est suffisante compte-tenu de la durĂŠe journalière dâensoleillement et ĂŠgalement du fait quâune dĂŠcharge totale est très rare.
Autres procĂŠdĂŠs de charge des batteries, plus rapide
Pour diminuer la durĂŠe de charge des batteries, il convient dâaugmenter le courant de charge. Mais cela pose le problème du dĂŠgagement gazeux excessif dĂť Ă lâĂŠlectrolyse de lâeau.
Une mÊthode de charge rapide consiste à augmenter la tension de charge au dessus de la tension de dÊgagement gazeux, de façon pÊriodique et ponctuelle. Le dÊgagement gazeux se produit de façon pÊriodique, mais celui-ci est contrôlÊ Êvitant des dommages à la batterie. Ce processus, appelÊ aussi dÊstratification prÊcoce, permet de rÊduire la durÊe de charge à 4 heures.
Dâautres procĂŠdĂŠs encore plus rapides permettent de rĂŠduire Ă 1 heures la durĂŠe de charge. Nous nâen parlerons pas dans cet ouvrage, mais il est Ă noter quâun brevet EDF/UniversitĂŠ Montpellier II a ĂŠtĂŠ dĂŠposĂŠ en 2008.

